Die digitale Transformation in akkreditierten Laboren: Aktueller Stand, Herausforderungen und Chancen, Teil 1

Die Digitalisierung ist in aller Munde und macht auch vor den Laboren nicht Halt. Immer mehr Finanztöpfe werden für die digitale Transformation bereitgestellt, immer mehr Budgets freigegeben.
Aber wie ist der aktuelle Stand in den akkreditierten Laboren? Welche Hindernisse blockieren die digitale Transformation? Und welche Möglichkeiten eröffnen sich zum Beispiel durch generative KI? Gibt es das Labor 4.0 schon? Diese Fragen werden im Rahmen dieses Artikels und des zweiten Teils erörtert.
Das VUP-Konjunkturbarometer, welches vom VUP Deutscher Verband Unabhängiger Prüflaboratorien e.V. herausgegeben wird, vom November 2023 zeigt: Der Bereich IT und Digitalisierung hält mit 0,5 sein positives Niveau und trotzt der Krisensituation, obwohl in den akkreditierten Laboren in vielen Bereichen weniger investiert wird. Die Laborbranche investiert damit ganz gezielt in Zukunftstechnologien. Auch die QZ (Ausgabe 5/24) beschreibt in einem Artikel, dass die Investitionen für KI 2024 im Durchschnitt um 30 Prozent erhöht wurden. Die Labore richten hohe Erwartungen an die Digitalisierung hinsichtlich Effizienzsteigerung und Ausweitung der Geschäftsfelder. Doch laut einer aktuellen Horváth-Studie drohen diese Investitionen in vielen Unternehmen aufgrund fehlender Voraussetzungen ohne Mehrwert zu versickern.
Aktueller Stand in verschiedenen Laborarten
Der digitale Reifegrad in den verschiedenen akkreditierten Laboren ist sehr unterschiedlich und wird insbesondere bei der Betrachtung verschiedener Laborbereiche deutlich. In den technischen Laborsparten, beispielsweise im Automotive-Bereich, ist die Digitalisierung bereits wesentlich weiter fortgeschritten als in den medizinischen Laboren. Die Akkreditierungsanforderungen bezüglich der Informationssicherheit sind jedoch annähernd gleich. Viele Qualitätsmanagementsysteme (QMS) der medizinischen Labore sind noch sehr oder ausschließlich papierbasiert aufgebaut. Oft hört man die Aussage: „Weil wir das schon immer so gemacht haben.“ Dass diese Labore trotz ihres papierbasiertem QMS, das nicht mehr dem „Stand der Technik“ entspricht, ihre Akkreditierung erfolgreich bestehen, verstärkt diese Haltung zusätzlich. Warum das ganze Managementsystem ändern und hierfür viel Geld, Zeit und Ressourcen in die Hand nehmen, wenn die Akkreditierungsstellen dies nicht explizit fordern? Der Vorteil der digitalen Transformation ist für die Labore nicht deutlich genug. Zusätzlich ist der Gegenwind durch die Mitarbeitende für diesen ausgeprägten Change-Prozess häufig sehr hoch.
Labore, die beispielsweise als interne Qualitätssicherungslabore in innovativen und modernen Unternehmen verankert sind, etwa in der Werkstoff-, oder Materialprüfung, pflegen oft gleichfalls moderne und agile Prozesse. Die Mitarbeitenden sind an Veränderungen und Innovationen gewöhnt und gelten als resilienter und flexibler als Mitarbeitende in sehr konservativen Laborsparten.
Bei der Beurteilung der Automatisierung und Digitalisierung muss jedoch grundsätzlich zwischen dem Probendurchlauf, das heißt dem Laborprozess zur Probenbearbeitung und dem nach DIN EN ISO/IEC 17025 oder DIN EN ISO 15189 aufgebauten Managementsystem für die Aufrechterhaltung der Akkreditierung unterschieden werden.
Der Probenbearbeitungsprozess wird durch sogenannte Laborinformationsmanagementsysteme, abgekürzt LIMS, automatisiert und digitalisiert. Besonders bei sehr hohen Probenzahlen steigt der Automatisierungsgrad des Laborprozesses proportional und LIMS werden häufiger implementiert. Da medizinische Labore häufig hohe Probenzahlen untersuchen, nutzen medizinische Labore oft elektronische LIMS für die automatisierte Bearbeitung der Proben und die Anbindung der Geräte für die elektronische Ergebnisübertragung.
In den Prüf- und Kalibrierlaboren, die nach DIN EN ISO/IEC 17025 akkreditiert sind, werden regelmäßig weniger Proben getestet und LIMS sind seltener anzutreffen. Das heißt, speziell für den Laborprozess ist der digitale Automatisierungsreifegrad bei den Prüf- und Kalibrierlaboren und den technischen Laborsparten weniger ausgeprägt als bei den medizinischen Laboren.
Auf Ebene der Qualitätsmanagementsysteme nach DIN EN ISO/IEC 17025 und DIN EN ISO 15189 sehen wir ein gegenteiliges Bild. Medizinische Labore pflegen oft ein papierlastiges Managementsystem, wobei die Prüf- und Kalibrierlabore tendenziell stärker, zum Beispiel durch CAQ Systeme oder SharePoint digitalisiert sind. Ein Großteil der Labore unterhält momentan noch ein Hybridsystem aus Papierdokumenten und elektronischen Dokumenten.
Digitalisierung ist also nicht gleich Digitalisierung. Die Labore müssen sich fragen, welche Prozesse ihr „Nadelöhr“ sind, in welche Prozesse unverhältnismäßig viele Ressourcen und Kapazitäten fließen. In welchen Bereichen müssen sie effizienter, schneller und sicherer werden? Welchen Risiken unterliegen ihre Prozesse? Mancherorts werden etwa veraltete, nicht mehr unterstützte Systeme und MS Access Datenbanken genutzt, die nur von einer Person im Unternehmen verwaltet werden können. Was passiert mit diesen Prozessen, wenn diese Person ausfällt? Die Auswirkung für das Labor ist ähnlich einem Cyber-Angriff – der Stillstand aller Testungen und Prozesse.
Digitaler Umstellungsprozess in den akkreditierten Laboren
Die Umstellung von analogen zu digitalen Prozessen erfolgt in den Laboren in unterschiedlichen Stufen. Ausgedruckte Papierdokumente werden durch Excel- und Word-Dokumente ersetzt. Diese werden nicht mehr ausgedruckt, sondern digital gepflegt, gegebenenfalls mit elektronischen Unterschriften versehen und in den Audits und Begutachtungen digital präsentiert.
Der nächste Reifeschritt ist der Ersatz dieser Dokumente durch kommerzielle Softwaresysteme und Datenbanken oder -sätze, wie zum Beispiel CAQ, SharePoint für die Dokumentenlenkung, Pflege und Ablage.
Die Königsdisziplin ist eine kommerzielle Softwarelösung, auch „Software as a Service“ genannt (SaaS), die bereits bei der Auslieferung alle Akkreditierungsanforderungen erfüllt und schnell, also ohne großes Softwareimplementierungsprojekt, gestartet werden kann. Diese SaaS Lösungen, wie zum Beispiel 17025_SaaS von AUDITTRAILS Networks, sind seit wenigen Jahren für die Labore käuflich zu erwerben und bilden über Datensätze die kompletten Akkreditierungsanforderungen ab. Zum Aufbau eines Managementsystems muss auf diesem Wege nicht alles eigenständig erarbeitet werden. Die Labore können sich sicher sein, dass sie alle Akkreditierungsanforderungen erfüllen.
Selbsteinschätzung der Labore zum vorliegenden Digitalisierungsstand
Was sagen die Labore selbst über den Grad ihrer Digitalisierung? Welche Prozesse wurden bereits digitalisiert? Eine QI-FoKus-Studie von 2024, die in Zusammenarbeit mit der BAM erstellt wurde, befragte über 1.300 internationale Labore zu Digitalisierungsthemen.
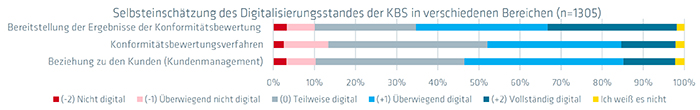
Abb. 1: Selbsteinschätzung des Digitalisierungsstandes der KBS in verschiedenen Bereichen. Quelle: QI-FoKus-Studie 2024 zur Digitalisierung in der Konformitätsbewertung: Ein internationaler Vergleich
Die Studie ergab, dass hauptsächlich die Übermittlung der Prüfergebnisse an die Kunden digital erfolgt.
Auch wurde festgestellt, dass Digitalisierung häufig erst in den letzten Jahren für die Labore relevant wurde. Jede zweite Konformitätsbewertungsstelle, unter anderem Labore, hat erst in den letzten 5 Jahren begonnen, sich mit der digitalen Transformation zu beschäftigen. Nur 20 Prozent haben dies bereits vor 10 Jahren getan.
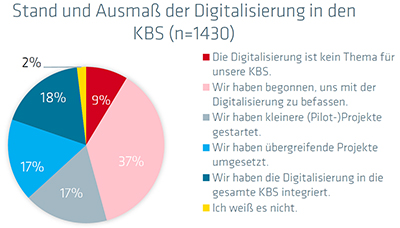 |
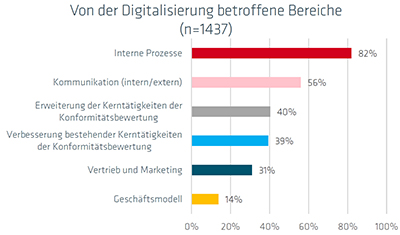 |
|
| Abb. 2: Stand und Ausmaß der Digitalisierung in den KBS. Quelle: QI-FoKus-Studie 2024 zur Digitalisierung in der Konformitätsbewertung: Ein internationaler Vergleich | Abb. 3: Von der Digitalisierung betroffene Bereiche. Quelle: QI-FoKus-Studie 2024 zur Digitalisierung in der Konformitätsbewertung: Ein internationaler Vergleich |
International haben nur 18 Prozent der Labore die Digitalisierung in das gesamte Labor integriert. Die meisten Digitalisierungsaktivitäten betreffen interne Prozesse, gefolgt von verbesserter Kommunikation. Nur in geringerem Ausmaß unterstützt die Digitalisierung jedoch die Erweiterung und Verbesserung der klassischen Labor-Tätigkeiten.
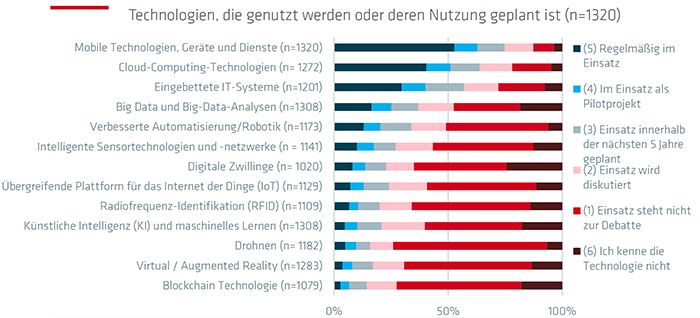
Abb. 3: Technologien, die genutzt werden oder deren Nutzung geplant ist. Quelle: QI-FoKus-Studie 2024 zur Digitalisierung in der Konformitätsbewertung: Ein internationaler Vergleich
Die neuesten digitalen Technologien, wie Blockchain, KI, Virtual Reality und Big Data Analytics werden nur in geringem Ausmaß in den akkreditierten Laboren eingesetzt. Regelmäßig zum Einsatz kommen bereits Mobile Technologien, Cloud-Computing-Technologien und eingebettete IT-Systeme. Auch Technologien und Anwendungen für Remote-Verfahren wie Videokonferenzsysteme und Chats sind fest im Alltagsgeschäft der Unternehmen verankert. Sie werden von 60 Prozent der befragten Unternehmen genutzt.
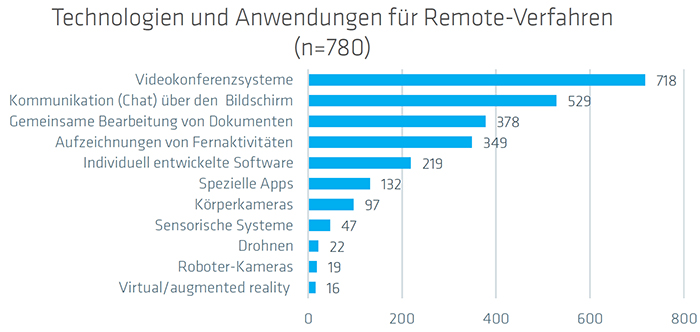
Abb. 4: Technologien und Anwendungen für Remote-Verfahren. Quelle: QI-FoKus-Studie 2024 zur Digitalisierung in der Konformitätsbewertung: Ein internationaler Vergleich
45 Prozent nutzen sie auch für ihre Audits. Als größte Hürden und Probleme bei den eingesetzten Remote-Methoden werden die mangelnde zwischenmenschliche Interaktion und Risiken bezüglich des Datenschutzes und der Informationssicherheit gesehen.
Mehr als die Hälfte der akkreditierten Routineprozesse wurden in 69 Prozent der internationalen Labore digitalisiert. 13 Prozent der Labore haben dagegen nicht einmal 10 Prozent ihrer Labortätigkeiten digitalisiert.
Zusammenfassung des aktuellen Standes der Digitalisierung in akkreditierten Laboren
In den letzten Jahren hat die Digitalisierung in diesen Laboren stark zugenommen. Die Fortschritte sind:
- Laborinformationssysteme (LIMS):
LIMS ermöglichen es, akkreditierten Laboren, die Probenbearbeitung und -verwaltung, die Datenverarbeitung sowie den gesamten Laborbetrieb automatisiert und digital abzubilden. Anfangs wurden diese Systeme häufig durch die eigene IT-Abteilung entwickelt. In den letzten Jahren wurden diese System wegen der gestiegenen Akkreditierungsanforderungen durch kommerzielle LIMS-Lösungen ersetzt. - Automatisierung von Prozessen:
Fortschrittliche Analysegeräte und Sensoren automatisieren die Datenerfassung und -analyse, was zu einer erhöhten Effizienz und Genauigkeit führt. Dies ist besonders wichtig für akkreditierte Labore, da die Genauigkeit und Reproduzierbarkeit der Ergebnisse von entscheidender Bedeutung sind. Besonders die Anbindung der Geräte an die Server führen durch die automatisierte Rohdaten- und Ergebnisübertragung zu enormen Effizienzsteigerungen und Fehlerreduzierungen. Auch die digitale Übertragung der Prüfergebnisse und Prüfberichte an die Kunden führt zu einem enormen Effizienzgewinn. - Datenmanagement und -sicherheit:
Die Nutzung von Cloud-Computing und Big-Data-Analyse ermöglicht es akkreditierten Laboren, große Datenmengen effizient und sicher zu speichern, zu verarbeiten und zu analysieren. Gleichzeitig wird die Sicherheit sensibler Daten gewährleistet. Diese Methodiken werden momentan in den internationalen Laboren noch nicht ausreichend genutzt. - Remote-Techniken:
Seit 2020 setzen Labore vermehrt Remote-Techniken für die Tätigkeiten und Kommunikationsabläufe in den Laboren ein. Videokonferenzsysteme stellen das am häufigsten verwendete Tool für die Remote-Arbeit dar, gefolgt von digitaler Kommunikation (Chat).
Über die Autorin
Susanne Kolb ist Geschäftsführerin der Laborberatungsfirma LaborConsultingGenius GmbH und berät seit über 10 Jahren alle Branchen von Prüf-, Kalibrier- und medizinischen Laboren bei Akkreditierungsprojekten nach DIN EN ISO/IEC 17025 und DIN EN ISO 15189. Zusätzlich war sie fast 10 Jahre leitende DAkkS Systembegutachterin und Fachbegutachterin und ist seit Jahren Trainerin und Prüferin des DGQ-Zertifikats Labormanagement.
Koch, C., Ladu, L (2022). QI-FoKuS-Studie in Zusammenarbeit mit der BAM, Auswirkungen der Corona-Pandemie auf Konformitätsbewertung und Konformitätsbewertungsstellen in Deutschland (qi-digital.de)
Koch, C., Ladu, L (2024, März). QI-FoKuS-Studie in Zusammenarbeit mit der BAM (www.bam.de)
Frenzl, A. (2024, 26.März). Blogbeitrag: Moderne Managementsysteme – AUDITTRAILS Networks GmbH
Zeitschrift Laborpraxis 2024 : Dossier – Digitalisierung im Labor
VUP-Konjunkturbarometer, November 2023 (VUP – Verband unabhängiger Prüflabore)
Zeitschrift QZ 5/24, Seite 7, KI ist der Managementhype 2024 – und eine Investment-Falle, Hanser Verlag, Herausgeber DGQ
April 2024, DIALOGPROZESS „DIGITALE QI IN PRÜF- UND KALIBRIERLABOREN – VOM TREND ZUM TAGESGESCHÄFT“ Zentrale Erkenntnisse aus den Praxiswerkstätten #1 und #2
Anforderungen an Laborpersonal nach ISO/IEC 17025

Kompetentes Fachpersonal ist nicht nur entscheidend für Prüf- und Kalibrierergebnisse, sondern auch für ein funktionierendes QM-System. Mit der Revision von ISO/IEC 17025 haben sich die Anforderungen an Laborpersonal verändert. In einem Managementsystem, das der Norm entspricht, müssen daher einige Dokumente verankert sein, welche die Erfüllung der Anforderungen nachweisen. (mehr …)
Warum rückgeführte Messergebnisse für Ihr Unternehmen notwendig sind

Rund um die Uhr wird gemessen. Im täglichen Leben beschäftigen wir uns eher unbewusst mit der Fragestellung, ob der Messwert überhaupt ein richtiger, gültiger Messwert ist. Vielleicht beim Kauf von hochpreisigen Lebensmitteln, bei einer gemessenen Geschwindigkeitsüberschreitung oder einer Reklamation, bewerten wir das Messergebnis auf seine Richtigkeit. In einer so schnelllebigen Zeit wie heute sind wir in einem besonderen Maß auf gültige Messergebnisse angewiesen. Aber wie kommen diese zustande, bzw. wann kann von einem gültigen Messergebnis die Rede sein?
Geeignete Mess- und Prüfmittel – das Herz jeder Produktion

Wer komplexe Produktionsprozesse oder Konformitätsbestätigungen sicher beherrschen möchte, muss auch die „Kunst des Messens“ beherrschen. Dazu gehört vor allem die Feststellung der Eignung von Mess- und Prüfmitteln. Tatsächlich geht es jedoch nicht um die Eignung von Mess- und Prüfmitteln, sondern um den Nachweis das die zur Anwendung kommenden Mess- und Prüfmittel inkl. der dazugehörigen Methoden für die jeweiligen Überwachungs- und Messtätigkeiten geeignet sind. Nur dadurch wird gewährleistet, dass die Risiken in Verbindung mit ungeeigneten Überwachungs- und Messtätigkeiten nahezu auf null reduziert werden. Zu den wesentlichen Risiken zählen:
- ungültige Konformitätsbestätigung (Auslieferung unsicherer Produkte)
- nicht wirksame Regelkreise in der Produktion (hoher Ausschuss)
- etwaiger Fehlerdurchschlupf zum Kunden (Reklamation, Kosten)
- nicht Einhaltung von gesetzlichen Forderungen (z.B. CE)
- Rückrufaktionen (erhebliche Kosten und Imageverlust)
- erhebliche Haftungsrisiken (z.B. Umweltrecht)
In allen gängigen branchenübergreifenden (z.B. ISO 9001, ISO 14001, ISO 45001, etc.) und -spezifischen (ISO 9100, HACCP, QSF, ISO 17025, DIN 27201-9, ISO 13485, IATF 16949, etc.) Standards ist das Thema „… gültige und zuverlässige Überwachungs- und Messergebnisse“ in Verbindung mit festgelegten Anforderungen“ als „muss“ Forderung enthalten. Dazu kommen dann noch die Anforderungen an die Eignung von Überwachungs- und Messtätigkeiten aus diversen Rechtsvorschriften.
Die Kernforderung von ISO 9001 ist nicht das Kleben von Plaketten an Mess- oder Prüfmitteln
Was ist die Kernforderung von ISO 9001 in Bezug auf Produktkonformität? Erinnern wir uns an die Einleitung zu ISO 9001 „Die potenziellen Vorteile für eine Organisation, die sich aus der Umsetzung eines Qualitätsmanagementsystems basierend auf dieser Internationalen Norm ergeben, sind folgende: a) die Fähigkeit, beständig Produkte und Dienstleistungen zu liefern, die die Kundenanforderungen und zutreffende gesetzliche und behördliche Anforderungen erfüllen;…“. Das heißt im Klartext, dass die definierte Produkt-/Dienstleistungsqualität abgesichert hergestellt wird.
Dazu fordert die Norm, dass die entsprechenden Ressourcen festgelegt und bereitgestellt werden müssen, um die Konformität von Produkten und Dienstleistungen durch Mess- oder Überwachungsergebnisse nachweisen zu können. Konformität wiederum bedeutet die Erfüllung von Anforderungen. Eine weitere wesentliche Anforderung von ISO 9001 ist, dass die Eignung der bereitgestellten Ressourcen für die jeweilige Mess- oder Überwachungstätigkeit gegeben ist. Der Nachweis dieser Eignung ist dann auch entsprechend zu dokumentieren. Da ISO 9001 eine sogenannte wirkzielorientierte Norm ist, sind keine Methoden zur Eignungsfeststellung festgelegt worden. Die Definition der Methoden zur Eignungsfeststellung obliegt somit dem Anwender der Norm.
Was verbirgt sich hinter der Eignungsfeststellung?
Grundlage für die Eignungsfeststellung (also den geeigneten Einsatz für den beabsichtigten Gebrauch) bilden die Spezifikationen der Merkmale des Produktes. Eine Eignung ist dann gegeben, wenn ein Mess- oder Prüfmittel die definierten Anforderungen an seine beabsichtigte Verwendung erfüllt. Die definierte Anforderung ist das erwartete Mess- oder Überwachungsergebnis, um die Konformität mit den Vorgaben bestätigen zu können. In der Regel sind diese Anforderungen in entsprechenden Prüfspezifikationen festgelegt.
Es gibt viele Möglichkeiten zur Eignungsfeststellung. Entweder über statistisch abgesicherte Verfahren oder einfach nur durch die Anwendung des technischen Verstandes in Verbindung mit umfassenden Kenntnissen der Messtechnik und der Messfehler und Fehlerursachen. Die sicherlich bekanntesten Verfahren zum Eignungsnachweis sind die Measurement System Analysis (MSA, AIAG) oder der VDA Band 5 (Prüfprozesseignung, Eignung von Messsystemen, Mess- und Prüfprozessen – bei geometrischen Merkmalen). Diese Verfahren sind jedoch nicht zwingend erforderlich, um die Eignung feststellen zu können. Eine Eignung ist auch dann gegeben, wenn der Abstand zwischen der Fehlergrenze des Mess- oder Prüfmittels wesentlich kleiner ist, als die Toleranzgrenze für die Konformitätsentscheidung. Wichtig ist, dass ein zuverlässiges und reproduzierbares Messergebnis erzeugt werden kann.
Absicherung der Eignung als Erfolgsfaktor
Nachdem einmal die Eignung eines Verfahrens zur Ermittlung gültiger und zuverlässiger Überwachungs- und Messergebnisse nachgewiesen wurde, besteht die zweite Kernaufgabe darin, die Eignung kontinuierlich sicherzustellen. Dazu zählt dann u.a. die regelmäßige Verifizierung der Überwachungs- und Messverfahren mit Hilfe geeigneter Standards oder die Kalibrierung der eingesetzten Mess- oder Prüfmittel. Nur durch diese Maßnahmen sind metrologisch rückführbare Überwachungs- und Messergebnisse zur Konformitätsbewertung darstellbar.
DIN EN ISO 9001:2015 „Qualitätsmanagementsysteme – Anforderungen“
DIN 32937:2018 „Mess- und Prüfmittelüberwachung – Planen, Verwalten und Einsetzen von Mess- und Prüfmitteln“
DIN EN ISO 10012:2004 „Messmanagementsysteme – Anforderungen an Messprozesse und Messmittel“
VDI/VDE 2600:2013 Bl. 1, „Prüfprozessmanagement – Identifizierung, Klassifizierung und Eignungsnachweise von Prüfprozessen“
IATF 16949:2016 „Qualitätsmanagement – System – Standard der Automobilindustrie“
DIN EN ISO 9001:2015 „Qualitätsmanagementsysteme – Anforderungen“
DIN EN ISO/IEC 17025:2018 Allgemeine Anforderungen an die Kompetenz von Prüf- und Kalibrierlaboratorien“
ISO/IEC-Leitfaden 99:2007 „Internationales Wörterbuch der Metrologie“
Testo Fibel – Prüfmittelmanagement und Kalibrierung / Die Forderungen der Richtlinien und deren praktische Umsetzung“
Jörg Roggensack ist von Haus aus Elektroniker und Calibration Engineer GAF sowie zertifizierter Auditor für div. Managementsysteme. Er hat umfassende Erfahrung als Managementsystemkoordinator und als Auditor für diverse Regelwerke und Managementsysteme (IMS, QM, UM, AS, GMP, GLP) sowie als LEP Assessor die er in über 27 Jahren bei der Bundeswehr, in der Industrie und bei Zertifizierungsgesellschaften sammeln konnte. Über mehrere Jahre bildete er u.a. Kalibriertechniker an der Technischen Schule der Luftwaffe in Kaufbeuren aus und begann seine industrielle Kariere als Kalibrierlaborleiter bei BEYSCHLAG. In diversen Veröffentlichungen, als Herausgeber des Weka Werkes der „Mess- und Prüfmittelbeauftragte“ und als Auditor, Trainer sowie Umsetzungsberater bei JR Management Services & Qualifizierung gibt er immer wieder Hilfestellungen zur Gestaltung wirtschaftlicher und normkonformer Mess- und Prüfmittelüberwachungssysteme.


