Nachvollziehbare und verlässliche Ergebnisse durch Computer System Validierung
Frederik Janas ist DGQ-Trainer des neuen E-Trainings „Computer System Validierung (CSV)“ für die Medizinprodukteindustrie und Experte für Medizinproduktesicherheit bei CRConsultants. Im Interview erläutert er, warum das Thema „Computer System Validierung“ im Kontext der Herstellung von sicheren Medizinprodukten so wichtig ist.
Herr Janas, der Begriff „Computer System Validierung“ ist sicher nicht jedem geläufig. Könnten Sie uns erklären, was er bedeutet?
Frederik Janas: Computer System Validierung bezeichnet die Prüfung und den dokumentierten Nachweis, dass ein Computersystem oder eine eigenständige Software spezifische Anforderungen erfüllt. Initial werden Spezifikationen definiert, die sowohl allgemeine Anforderungen als auch spezifische Benutzerfälle darstellen. Im weiteren Verlauf der CSV werden Nachweise in Form von Tests geplant, durchgeführt und dokumentiert. Anders ausgedrückt, vorab wird definiert, wie ein Computersystem oder eine Software funktionieren soll und im Rahmen der Validierung wird geprüft, ob diese Funktion verlässlich und korrekt erfüllt wird.
Welche Arten von Software oder Computersystemen gibt es im Kontext der Medizinprodukteherstellung und müssen sie alle validiert werden?
Frederik Janas: Es können zwei verschiedene Arten von Computer Systemen beziehungsweise Software unterschieden werden. Erstens solche, die in der Produktion von Medizinprodukten oder Dienstleistungserbringung und für das Qualitätsmanagementsystem zum Einsatz kommen, Datenanalysesoftware zum Beispiel. Diese sind gemäß den Anforderungen der ISO 13485 zu validieren.
Zweitens solche, die selbst eigenständige Medizinprodukte – Software as a Medical Device (kurz SaMD) – oder Teil eines Medizinprodukts sind. Zum Beispiel könnte das Software sein, die für Überwachungs- oder Diagnosesysteme benötigt wird. Diese Software muss gemäß der ISO 62304 beziehungsweise ISO 82304 validiert werden.
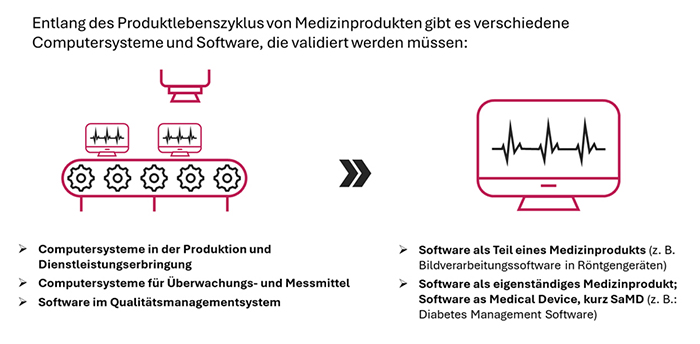
Abb. 1: Software- und Computersysteme im Kontext der Medizinprodukteherstellung
Warum ist die Validierung von Computersystemen so wichtig?
Frederik Janas: Zum einen müssen regulatorische Anforderungen eingehalten werden, der risikobasierte Ansatz der CSV ist beispielsweise normativ durch die ISO 13485 gefordert, die unter anderem bei Audits durch Benannte Stellen überprüft werden. Wir konnten feststellen, dass die CSV in den letzten Jahren verstärkt in den Fokus der Auditor:innen gerückt ist. Außerdem trägt die CSV zur Sicherheit und Einhaltung der Qualität von Medizinprodukten im Zusammenhang mit der Anwendung von Softwaresystemen bei. Da die Funktionen von heutigen Softwaresystemen immer komplexer werden, wird es immer schwieriger, nachvollziehbare Ergebnisse zu erzielen. Eine CSV hilft durch strukturierte Verfahren, die Validität der Ergebnisse zu beweisen.
Könnten Sie uns einen Überblick darüber geben, welche verschiedenen Arten der Validierung es gibt?
Frederik Janas: Neben der Computer System- beziehungsweise Softwarevalidierung werden Validierungen auch für Testmethoden, Umgebungsbedingungen sowie Prozesse und Ausrüstungen durchgeführt. Auch hier geht es immer darum sicherzustellen, dass die definierten Anforderungen verlässlich erfüllt werden. Beispielsweise zielt die Prozessvalidierung darauf ab, die Wirksamkeit der Prozesse, die gegebenenfalls im Zusammenhang mit der Softwareentwicklung- und -anwendung stehen, zu überprüfen. Im Rahmen der Digitalisierung ist Software ein häufiger Bestandteil in der Produktion oder bei der Überwachung von Anforderungen. Somit kann es bei allen Arten der Validierungen Schnittstellen zur Computer System Validierung geben.
Welche Konsequenzen können auftreten, wenn eine angemessene Computer System Validierung nicht durchgeführt wird?
Frederik Janas: Regulatorisch kann dies Konsequenzen in Form von Abweichungen bei Audits nach sich ziehen. Zudem kann durch fehlerhafte Funktionen die Produktqualität und Patientensicherheit beeinträchtigt werden. Mögliche Auswirkungen aufgrund nicht valider Computersysteme können falsche Parameter in der Produktion, falsche Angaben auf Produkten, falsche Ergebnisse in der Überwachung von Medizinprodukten oder mangelnde Rückverfolgbarkeit im Qualitätsmanagementsystem sein.
Lassen Sie uns die Praxis gemeinsam beleuchten. Welche Schritte umfasst der Validierungsprozess konkret?
Frederik Janas: Allgemein sind die Schritte der Validierung gemäß V-Modell in das Definieren von Anforderungen, das Testen von Funktionen und das Dokumentieren der Kriterien und Ergebnisse unterteilt. Der Umfang ist stark abhängig von der Komplexität der Anwendung sowie dem Risiko. Hier liefert die Software-Kategorisierung gemäß GAMP 5 (Good Automated Manufacturing Practice) eine gute Richtlinie, in der Software abhängig von der Standardisierung und Konfiguration eingestuft wird. Das bedeutet, dass in der Praxis die Schritte individuell definiert werden. Für eine einfache Software wie beispielsweise ein Excel-Sheet umfasst der Validierungsprozess gegebenenfalls nur einen Prüfplan, in dem die Beschreibung, Anforderung, Methodik und das Risiko beschrieben sind, sowie einen Prüfbericht, der die Ergebnisse darstellt. Für eine komplexe Software mit hohem Risiko sind mehr Schritte notwendig. Hierbei kann initial eine Risikobewertung durchgeführt und die Anforderungen in verschiedenen Detaillierungsstufen definiert werden. Daraus resultieren häufig mehrere Prüfpläne und -berichte.
Und zu guter Letzt, welche Werkzeuge und Methoden werden für die Validierung von Computersystemen eingesetzt?
Frederik Janas: Das wichtigste Werkzeug ist eine Softwaremasterliste sowohl aus interner Sicht als auch aus Sicht eines externen Auditors. Diese schafft eine Übersicht aller verwendeten Computersysteme inklusive weiterer Angaben unter anderem zur Validierungspflicht. Weiterhin ist die Risikobewertung in Form einer initialen Bewertung oder FMEA ein wichtiges Werkzeug, um die Validierungstätigkeiten risikobasiert zu priorisieren. Während der Validierung werden verschiedene Testmethoden herangezogen. So zum Beispiel Positiv-, Wiederholungs- und Regressionstests. Diese werden spezifisch für den Test ausgewählt und sollen einen geeigneten Nachweis zur Erfüllung der Anforderungen erbringen.